¿Cómo actúa la insulina?
En términos muy simples, existen dos cascadas principales de reacciones bioquímicas entre proteínas median la acción de la insulina a nivel intracelular: una vía está involucrada en la regulación del metabolismo energético y la otra juega un papel en el control de los procesos de crecimiento.
La regulación de estas dos vías distintas puede disociarse.
De hecho, estudios sugieren que la vía que regula el metabolismo energético está alterada en la “prediabetes” y en la diabetes tipo 2, mientras que la regulación de los procesos de crecimiento y las mitosis es normal.
Aunque muchos tipos de células de nuestro cuerpo expresan receptores de insulina, el papel de la insulina en la homeostasis de la glucosa se caracteriza por sus efectos directos sobre el músculo esquelético, el hígado y los adipocitos blancos.
En el músculo esquelético, la insulina promueve la utilización y el almacenamiento de glucosa al aumentar el transporte de glucosa y la síntesis (formación) de glucógeno.
En el hígado, la insulina activa la síntesis de glucógeno, aumenta la expresión de genes lipogénicos (que forman grasa) y disminuye la expresión de genes gluconeogénicos (aquellos genes que permiten la formación de glucosa a partir de grasa y proteínas).
En el tejido adiposo blanco (WAT), la insulina suprime la utilización de la grasa como energía (lipólisis) y aumenta el transporte de glucosa y la formación de grasa como reserva de energía (lipogénesis)
Y en el páncreas, suprime la secreción de glucagon con la consecuente reducción de la formación de glucosa por el hígado (gluconeogenesis).
Profundizando, les contaré los efectos de la insulina en los principales sitios de acción, músculos, hígado y tejido adiposo.
En las células musculares (miocitos):
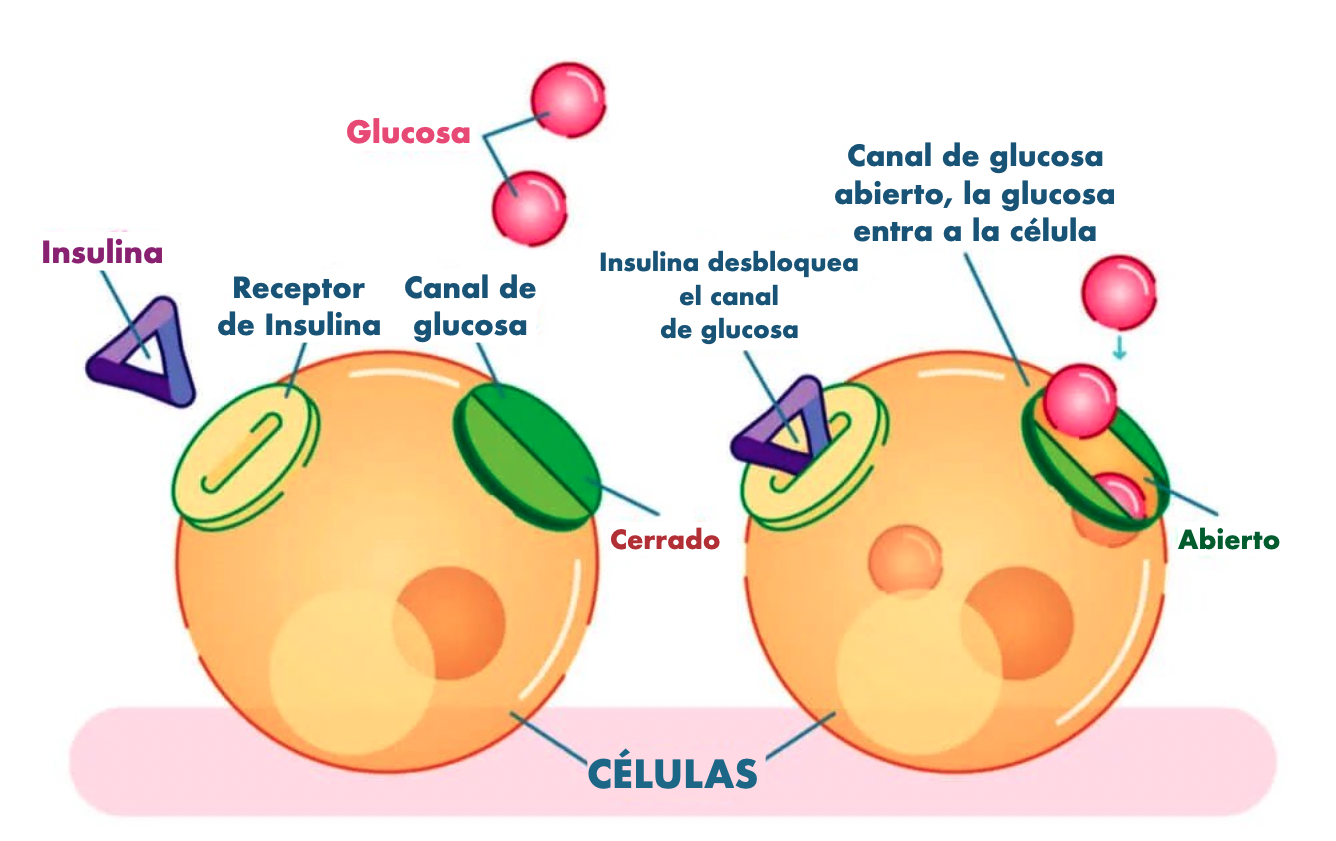
La insulina aumenta el transporte de glucosa hacia su interior a través de la translocacion y fusión de transportadores de glucosa GLUT4 con la membrana celular

La glucosa que entra en el miocito tras la estimulación con insulina tiene dos destinos principales:
- la glucólisis (producción de energía) o
- la síntesis de glucógeno (almacenamiento de energía).
La oxidación de la glucosa para producir energía (glucólisis), aumenta a medida que hay mayor disponibilidad de sustrato, lo que impulsa el flujo glucolítico; y además, en el músculo en ayunas, la insulina per se aumenta la oxidación relativa de glucosa de ~5 a ~60%, el resto de energía proviene de la oxidación de ácidos grasos libres.
Por otro lado, la insulina favorece la transcripción de la hexokinasa II, la isoforma primaria del músculo esquelético de la primera enzima de la vía glucolítica, lo que proporciona un control relativamente lento y basto de la capacidad glucolítica.
Sin embargo, la vía principal de eliminación de glucosa estimulada por la insulina tanto en el músculo de una persona sana como en aquellas con Diabetes tipo 2 es la síntesis de glucógeno (~75 %), en consonancia con el papel anabólico de la insulina como hormona de almacenamiento de energía.
A diferencia de la glucolisis, la síntesis de glucógeno está sujeta a una regulación mucho más precisa y rápida por parte de la insulina tanto de los flujos anabólicos (mediada por glucógeno sintasa) como catabólicos (mediada por glucógeno fosforilasa)
En las células hepáticas (hepatocitos):
La insulina del páncreas endocrino se secreta en la vena porta, por lo que el hígado está expuesto a concentraciones de insulina de dos a tres veces más altas que las de la circulación general. Es importante tener en cuenta que el incremento en la concentración de insulina plasmática medido desde un sitio periférico (como la que medimos en los exámenes de sangre habituales) no es igual al incremento en la concentración de insulina en la vena porta que llega al hígado.
En el hígado, la insulina promueve la síntesis de las 3 principales macromoléculas metabólicas: glucógeno, lípidos y proteínas.
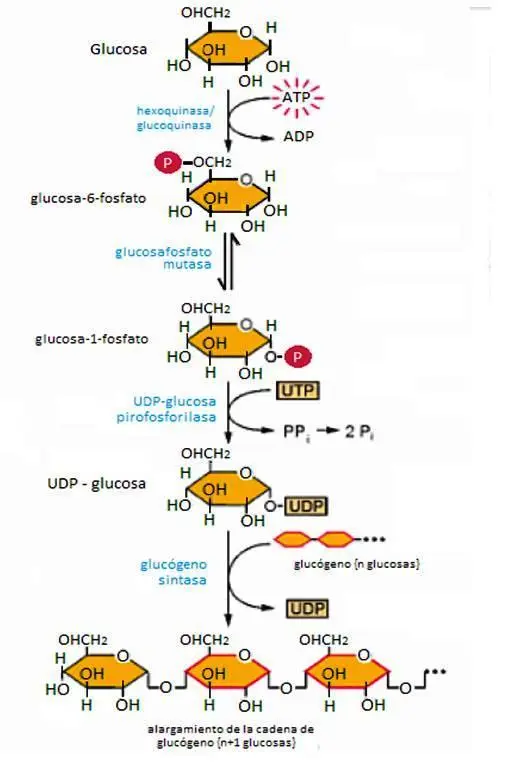
GLUCOGENOGÉNESIS (formación de glucógeno)
Respecto a la influencia de la insulina sobre el metabolismo de la glucosa a nivel hepático, podemos decir que …
- La insulina reduce rápida y potentemente la producción de glucosa hepática: cuando hay glucosa circulante disponible (por ejemplo después de una comida), no será necesario que nuestro hígado la sintetice como cuando estamos en ayuno.
- La insulina estimula la síntesis neta de glucógeno después de una comida: esta es una función fisiológica directa de la insulina en el hepatocito. En humanos, la media de la estimulación máxima de síntesis de glucógeno hepático en condiciones hiperglucémicas e hipoglucagonémicas ocurre con concentraciones de insulina en la vena porta de 20–25 uU/ml.
- Sin embargo, el transporte de glucosa hacia dentro del hepatocito no está regulado por insulina y, por lo tanto, la insulina ejerce un control menos completo sobre las tasas de síntesis de glucógeno que en el músculo esquelético. Por ejemplo, la hiperglucemia (aumento de glicemia en sangre) es suficiente para inactivar la fosforilasa de glucógeno hepático y, por lo tanto, promover la síntesis neta de glucógeno hepático.
- Aunque el transporte de glucosa no está bajo el control de la insulina en el hígado, la insulina todavía regula la glucógeno sintasa y la consecuente síntesis de glucógeno, aumentando la utilización y el almacenamiento de la glucosa a nivel hepático.
- Por otro lado, la insulina suprime el flujo glucogenolítico (suprime la de degradación de glucógeno).
Por estos mecanismos, podemos notar que son la insulina y la glucosa las que trabajan en conjunto para regular el metabolismo del glucógeno hepático.
En resumen, los estudios fisiológicos respaldan un modelo en el que la hiperinsulinemia es necesaria y suficiente para aumentar la síntesis de glucógeno hepático, la hiperglucemia es necesaria y suficiente para suprimir la glucogenólisis hepática, y tanto la hiperinsulinemia como la hiperglucemia son necesarias para promover la síntesis neta de glucógeno hepático.
Además, la insulina también tiene efectos hepatocelulares directos sobre el metabolismo de los lípidos.
El más destacado es favorecer la expresión varios genes de lipogénesis de novo (síntesis de grasa a partir de aminoácidos y glucosa), aunque también se ha informado un aumento de la eliminación de lipoproteínas ricas en triglicéridos y una disminución de la síntesis de lipoproteínas de muy baja densidad (VLDL). El efecto general es promover el almacenamiento de lípidos en el hepatocito y disminuir la disponibilidad de ácidos grasos para la oxidación (conversión en energía) por parte de otros tejidos.
De hecho, las concentraciones de triglicéridos en plasma disminuyen precipitadamente dentro de los 15 min de la infusión de insulina, aunque en el contexto de una comida rica en carbohidratos y grasa, los triglicéridos absorbidos anularán este efecto.
En las células grasas blancas (adipocitos):

El adipocito blanco (WAT) es tremendamente sensible a la insulina. La potencia de la insulina para controlar los niveles plasmáticos de ácidos grasos libres (NEFA) es fundamental para el mantenimiento de la euglicemia (niveles normales de glicemia); además, la supresión de la lipólisis (degradación de la grasa) también es una función fisiológica importante de la insulina en los adipocitos blancos.
Los 2 efectos más relevantes de la insulina en el adipocito son:
- La supresión de la lipólisis: esta supresión muestra una fuerte dependencia de los niveles de insulina en plasma. La concentración media efectiva de insulina para suprimir la lipólisis es de 20uUI/ml y debido a que los niveles de insulina plasmática en humanos sanos (sin diabetes) varía solo de 5 a 60 uU/ml, la regulación fisiológica de la lipólisis en el adipocito blanco tiene un rango mayor en comparación con la regulación de la captación de glucosa mediada por la insulina, que tiene una concentración media efectiva de 60 uU/mL y solo alcanza niveles máximos en concentraciones suprafisiológicas de insulina de >200 uU/mL .
- La estimulación del transporte de glucosa hacia el interior del adipocito.
Ahora les comentaré sobre los efectores involucrados en la regulación de la lipólisis y la captación de glucosa en los adipocitos.
La supresión de insulina de los niveles plasmáticos de ácidos grasos se produce a través de una rápida inhibición de la lipólisis de triglicéridos en los adipocitos.
La insulina es la hormona antilipolítica más potente y actúa rápidamente;
los niveles de ácidos grasos libres se suprimen en ~90 % dentro de los 5 min de elevar la insulina a los niveles posprandiales (después de comer). Los mecanismos mejor conocidos para la supresión de la lipólisis por parte de la insulina implican la atenuación o reversión de la señalización adrenérgica a través del cAMP y la proteína quinasa A (PKA).
Para comprender la regulación de la lipólisis por parte de la insulina, resumiremos los mecanismos dependientes de cAMP/PKA. La PKA fosforila dos proteínas clave involucradas en la lipólisis: la lipasa sensible a hormonas (HSL) y la perilipina (PLIN).
Cuando los niveles de insulina son relativamente bajos, la lipasa sensible a hormonas es fosforilada y se moviliza desde el citoplasma a la superficie de la gota lipídica acelerando la degradación inicial de los triglicéridos a ácidos grasos libres y glicerol, promoviendo su liberación a la sangre y su utilización como sustrato energético . El control hormonal completo de la tasa lipolítica también requiere la proteína perilipina que recubre las gotitas de lípidos.
Las funciones precisas de la fosforilación de perilipina en el control lipolítico no se comprenden completamente, pero se cree que involucran al menos tres mecanismos principales.
- Primero, la fosforilación de perilipina disminuye su afinidad por el cofactor de triacilglicerol lipasa (ATGL) CGI-58, lo que permite que este cofactor se libere y se una a la triacilglicerol lipasa y aumente su actividad por 20 veces.
.
- En segundo lugar, la fosforilación de perilipina es importante para la activación completa de la lipasa sensible a hormonas en la superficie de las gotitas de lípidos.
- En tercer lugar, se ha demostrado que la fosforilación de perlipina aumenta la relación entre el área superficial y el volumen de las gotitas de lípidos al estimular la gemación de microvesículas de lípidos; esto puede aumentar el acceso de la lipasa sensible hormonas al sustrato, pero requiere una exposición prolongada a la estimulación adrenérgica y, por lo tanto, es probable que no participe en la respuesta lipolítica aguda.
Al elevarse los niveles de insulina se suprime la lipólisis principalmente a través de la fosfodiesterasa 3B (PDE3B). PDE3B degrada cAMP para atenuar la señalización prolipolítica de PKA hacia la lipasa sensible a hormonas y perilipina disminuyendo la actividad de ambas moléculas .
Además, la insulina tiene efectos lipogénicos, promoviendo la síntesis de triglicéridos
Así como el almacenamiento de glucógeno hepático neto depende del equilibrio entre la glucogenólisis y la síntesis de glucógeno, la lipólisis neta es la suma de los flujos de la lipólisis y la reesterificación de los ácidos grasos libres a triglicéridos. Esta reesterificación puede actuar sobre los ácidos grasos que se originan en el interior del adipocito o en la circulación .
Durante el ayuno, casi no se produce reesterificación a triglicéridos en los adipocitos, porque la grasa se esta usando como sustrato energético, pero tras ingerir carbohidratos y la consecuente elevación sanguínea de la glucosa, esta induce una reesterificación sustancial para almacenar esos ácidos grasos en forma de triglicéridos y dar prioridad a la utilización de glucosa como fuente de energía.
Otros efectos lipogénicos se relaciona con:
- La captación de glucosa estimulada por la insulina, que proporciona una fuente de glicerol-3-fosfato al que se pueden esterificar los ácidos grasos libres, formando trigliceridos.
- La insulina aumenta la actividad de la lipoproteína lipasa en el endotelio del tejido adiposo.
- La insulina promueve la translocación de las proteínas transportadoras de ácidos grasos FATP1 y FATP4 en los adipocitos.
- La insulina también estimula la adipogénesis a través del receptor activado por el proliferador de peroxisomas del factor de transcripción γ (PPAR-γ)
- La insulina tiene otras funciones pro-lipogénicas en el adipocito; activa SREBP-1c y su programa transcripcional lipogénico tal como lo hace en los hepatocitos. Sin embargo, la lipogénesis de novo representa una fracción muy pequeña de la lipogénesis en los adipocitos; la esterificación de ácidos grasos preformados es la vía lipogénica predominante.
Como puedes ver, los efectos de la insulina sobre los miocitos, hepatocitos y adipocitos permiten regular el flujo de energía y la utilización de los diferentes sustratos energéticos de manera predominante según los niveles de insulina en la sangre, y como recordarás el principal estimulo para que se produzca la insulina es la ingesta, sobre todo de comidas ricas en carbohidratos.
Existe una variedad de entidades clínicas que se asocian a concentraciones elevadas de insulina en ayuno (hiperinsulinemia) por ejemplo: Resistencia a la insulina, Prediabetes, Lipodistrofia, Síndrome de ovario poliquistico e higado graso entre otras.
De hecho la resistencia a la insulina se considera como el mejor predictor de Diabetes tipo 2 en el futuro.
Como corolario, podemos decir que a nivel del metabolismo energético, la insulina circulante en la sangre se une a su receptor y provoca una cascada intracelular de reacciones bioquímicas, para finalmente producir un aumento del ingreso de glucosa hacia dentro de la célula y la disminución de la utilización de la grasa como fuente energética favoreciendo la síntesis de ácidos grasos para su almacenamiento en el tejido adiposo.
En un próximo post profundizaremos en la fisiopatología de la resistencia a la insulina.
Suscríbete a nuestra newsletter al final de esta pagina 👇🏻 para que no te pierdas nuestras próximas publicaciones!!
Referencia: “MECHANISMS OF INSULIN ACTION AND INSULIN RESISTANCE”, Max C. Petersen and Gerald I. Shulman Physiol Rev 98: 2133–2223, 2018